EL
ENLACE COVALENTE COORDINADO
Cuando el par de
electrones compartidos pertenece solo a uno de los átomos enlazados se
presenta un enlace covalente coordinado
o dativo. El átomo
que aporta el par de electrones se llama donador
y el que los recibe receptor o
aceptor. El donador siempre será
el elemento menos electronegativo. Este
enlace una vez formado no se diferencia para nada del enlace covalente normal. Sin embargo debido a cómo se origina se le
denomina enlace covalente dativo o coordinado.
REGLA DEL
OCTETO
A principios del siglo XX, en 1916, de
manera independiente, los científicos Walter
Kossel y Gilbert Lewis concluyeron
que la tendencia que poseen los átomos de lograr estructuras similares a las
del gas noble más cercano explica la formación de los enlaces químicos. Esta conclusión es conocida en todo el mundo como
la Regla del Octeto y se enuncia así:
“Cuando se forma un enlace químico los átomos reciben, ceden o comparten
electrones de tal forma que la capa más externa de cada átomo contenga ocho
electrones, adquiriendo estos la
estructura electrónica del gas noble más cercano en el sistema periódico”.
ESTRUCTURAS
DE LEWIS O FÓRMULAS DE PUNTOS
La representación del modo en que se ubican
los electrones más externos o de valencia en una molécula, se lleva a cabo
mediante las llamadas fórmulas o estructuras de Lewis. En este método, los electrones de valencia de
cada átomo se representan por medio de puntos, mientras que un enlace por medio
de un guión, cada uno representa un par de electrones.
Aspectos a considerar en una estructura de Lewis
* Cada
enlace se formará a partir de dos, y solamente dos electrones.
* Cada átomo (que no sea hidrógeno) deberá
cumplir con la regla del octeto.
* El hidrógeno deberá tener sólo 2
electrones para cumplir con la regla del dueto.
PROCEDIMIENTO
PARA DIBUJAR UNA ESTRUCTURA DE LEWIS
1. Calcular el número de electrones de valencia.
Para los elementos representativos el número de valencia es igual al número de columna donde se ubica el elemento. Los electrones de valencia se pueden calcular por la siguiente expresión:
electrones de valencia = (No. de columna)(No. de átomos en cuestión)
NOTA:
Cuando la especie a dibujar posee carga,
esta se debe considerar en el número de electrones de valencia así:
a) Si la carga es positiva, se resta al total de
electrones de valencia un número de electrones igual a la carga de la especie.
b) Cuando la carga es negativa, se suma a los
electrones de valencia un número de electrones igual a la carga de la especie.
2. Número total de electrones de manera que a cada átomo de hidrógeno se le asignen 2 electrones y a cualquier otro átomo 8 electrones.
No. total de electrones =
2(No. de hidrógenos) + 8(No. de átomos diferentes al hidrógeno)
3.
Número de electrones de enlace.
No.
electrones de enlace = (electrones paso 2 - electrones
paso 1 )
4.
Número de enlaces.
Como cada enlace químico involucra 2 electrones, el número de enlaces se
calcula dividiendo el número de electrones de enlace entre dos.
No. de enlaces = ( No. de electrones de enlace ) / 2
5. Número de electrones sin compartir ( electrones libres ).
Electrones sin compartir = No. electrones de valencia - No. electrones de enlace
6. Dibujar la posible estructura, considerando que cada átomo de hidrógeno sólo puede formar un enlace y cualquier otro átomo un total de cuatro.
7. Cálculo de la carga formal.
El cálculo de la carga formal permite establecer si la estructura dibujada es o no correcta. Es importante considerar que las posibles estructuras no deben violar la denominada regla de la carga adyacente. Esta regla establece que en una estructura no puede haber dos átomos adyacentes con cargas de igual signo, pues esto implica repulsión entre los átomos y por consiguiente no se forma el enlace.
La carga formal se puede calcular por la siguiente expresión:
Carga formal = (No. de columna del átomo ) – (No. de enlaces que forma el átomo
– ( No. de electrones sin compartir que posee el átomo)
Ejemplo: Dibujar la estructura de Lewis para el radical fosfato: PO4 –3
1. Cálculo para los electrones de valencia.
El átomo de fósforo está ubicado en la columna VA, por consiguiente su número de electrones de valencia es 5; solamente hay 1 átomo de fósforo.
El átomo de oxígeno se encuentra en la columna VIA, siendo su número de electrones de valencia igual a 6; además hay 4 átomos de oxígeno.
Como la especie fosfato posee una carga negativa, debe sumarse al total de electrones de valencia la carga, es decir 3 electrones.
electrones de valencia = (5)(1) + (6)(4) + 3 = 32
2. El número total de electrones se calcula por la expresión:
No. total de electrones = 2( No. de H ) + 8(No. de átomos diferentes al H )
Para el radical fosfato, el número de átomos de hidrógeno es cero, mientras que el número de átomos diferentes al hidrógeno es cinco, uno de fósforo y cuatro de oxígeno.
No. total de electrones = 2( 0 ) + 8( 5 ) = 40
3. No. de electrones de enlace = electrones paso 2 - electrones paso 1
No. electrones de enlace = 40 – 32 = 8
4. Nùmero de enlaces = No. electrones de enlace / 2
Número de enlaces = 8 /
2 =
4
5. Número de electrones sin compartir = 32 - 8 = 24
6. Posible
estructura:
7. Carga formal = No. columna – No. de enlaces – No. electrones sin compartir
Carga formal para el átomo de fósforo = 5 – 4 – 0
= +1
Carga formal para el átomo de oxìgeno = 6 – 1 – 6 = -1
En este ejemplo solamente se ha calculado la carga formal de un átomo de oxígeno debido a que todos presentan las mismas características en la estructura.
Al colocar la carga formar en cada átomo de la estructura se puede
observar que no se viola la regla de la carga adyacente y que además la suma
algebraica de todas las cargas parciales es igual a la carga del radical
fosfato, -3.
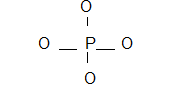

No hay comentarios:
Publicar un comentario